Recherche
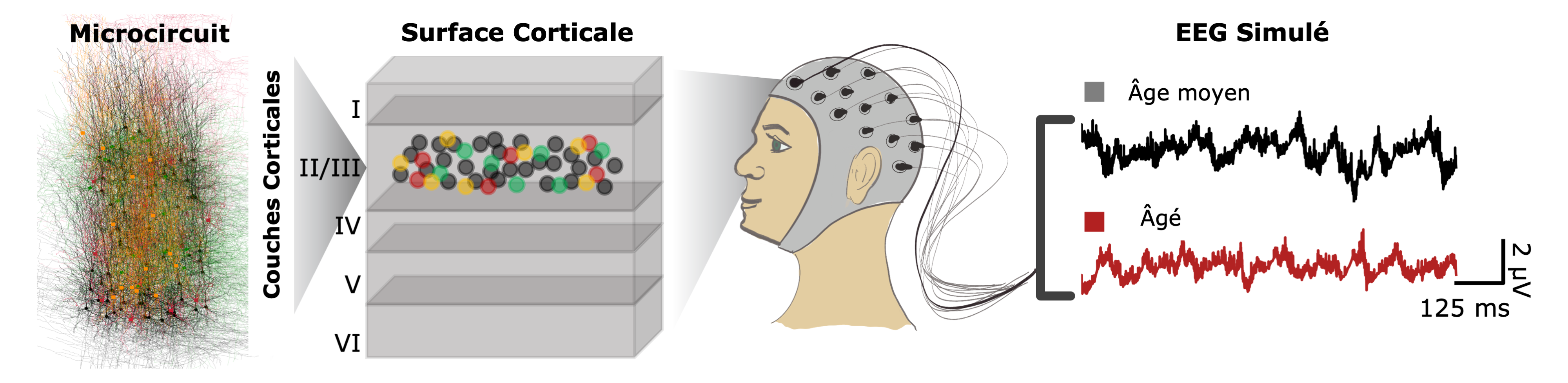
Mes recherches portent sur la compréhension des rôles des interneurones inhibiteurs clés dans la santé cérébrale et les maladies. Lors de mon doctorat, j’ai développé des modèles biophysiques d’interneurones hippocampiques, révélant leurs mécanismes liés aux canaux ioniques, le recrutement synaptique pendant le comportement, ainsi que les changements liés à l’âge. Pendant mon postdoctorat, j’ai créé des modèles basés sur des données de microcircuits corticaux humains afin d’étudier le vieillissement et la dépression. Grâce à ces modèles, j’ai mis en évidence comment des altérations mécanistiques perturbent le traitement sensoriel, testé de nouveaux composés thérapeutiques pour la récupération in silico, et identifié des biomarqueurs EEG permettant de suivre l’efficacité des médicaments et les troubles cognitifs. De plus, j’ai utilisé ces modèles et biomarqueurs pour entraîner des réseaux neuronaux artificiels capables de prédire les mécanismes sous-jacents aux dysfonctionnements des microcircuits chez des patients âgés à partir de données EEG.
Éducation
Ph.D. Physiology (Doctorat en Physiologie) | Dr. Frances Skinner Lab, University of Toronto, Sep. 2015-Nov. 2019
M.Sc. Physiology (Maîtrise en Physiologie) | Dr. Frances Skinner Lab, University of Toronto, Sep. 2013-Sep. 2015
B.Sc. Highest Honors Neuroscience, Minor Chemistry (Baccalauréat avec mention en Neurosciences, mineure en Chimie) | Carleton University, Ottawa, ON, 2009-2013
Expérience
Chercheur postdoctoral | Laboratoire Dr. Etay Hay, Krembil Centre for Neuroinformatics, CAMH, Déc. 2019 – Présent
- Conception de modèles biophysiques de microcircuits corticaux humains utilisant des algorithmes d’optimisation génétique pour étudier la dépression et le vieillissement, permettant la pharmacologie virtuelle et une compréhension mécanistique des dysfonctionnements cérébraux.
- Simulation des effets de nouveaux médicaments pour évaluer la récupération du traitement neural en fonction de la dose, soutenant la découverte de biomarqueurs et le criblage de médicaments in silico.
- Développement de modèles d’apprentissage automatique basés sur des caractéristiques EEG simulées pour prédire la sévérité de la dépression et optimiser le dosage thérapeutique (outil en instance de brevet).
- Modélisation des changements liés à l’âge dans la physiologie neuronale pour révéler les mécanismes responsables des altérations de l’activité corticale chez les personnes âgées.
- Direction du développement d’algorithmes et analyses intégratives combinant EEG, électrophysiologie et transcriptomique en collaboration avec des équipes de recherche multidisciplinaires.
- Obtention de bourses et contribution à la validation des prédictions des modèles via des études collaboratives.
Chercheur diplômé | Laboratoire Dr. Frances Skinner, Krembil Centre for Neuroscience, UHN, Sep. 2013 – Nov. 2019
- Conception de modèles biophysiques d’interneurones désinhibiteurs de l’hippocampe (cellules I-S3) pour identifier les mécanismes des canaux ioniques liés à l’excitabilité et à l’activation liée au comportement.
- Prédiction du recrutement synaptique des cellules I-S3 lors de comportements liés à la mémoire, avec validation in vivo par des collaborateurs.
- Simulation des effets des cellules I-S3 sur leurs cibles synaptiques (cellules OLM) pour quantifier la modulation de la désinhibition sur la filtration excitatrice dans les circuits hippocampiques.
- Collaboration sur des projets multi-études intégrant travaux computationnels et expérimentaux autour du vieillissement, de la mémoire et de l’encodage de la nouveauté, contribuant à plusieurs publications évaluées par des pairs.
Publications
- Guet-McCreight A, et al. (2024). Therapeutic dose prediction of α5-GABA receptor modulation from simulated EEG of depression severity. Plos Comput Biol. DOI: 10.1371/journal.pcbi.1012693.
- Guet-McCreight A, et al. (2024). In-silico testing of new pharmacology for restoring inhibition and human cortical function in depression. Commun Biol. DOI: 10.1038/s42003-024-05907-1.
- Tamboli S, Singh S, Topolnik D, Amine Barkat MEI, Radhakrishnan R, Guet-McCreight A, Topolnik L. (2024). Mouse hippocampal CA1 VIP interneurons detect novelty in the environment and support recognition memory. Cell Reports. 43(4):114115. DOI: 10.1016/j.celrep.2024.114115.
- Mazza F, Guet-McCreight A, Prevot TD, Valiante TA, Sibille E, Hay E. (2024). EEG biomarkers of α5-GABA positive allosteric modulators in rodents. BP:GOS. DOI: 10.1016/j.bpsgos.2024.100435.
- Mazza F, Guet-McCreight A, Valiante TA, Griffiths JD, Hay E. (2023). In-silico EEG biomarkers of reduced inhibition in human cortical microcircuits in depression. Plos Comput. Biol. DOI: 10.1371/journal.pcbi.1010986.
- Chen Y, Hunter E, Arbabi K, Guet-McCreight A, Consens M, Felsky D, Sibille E, Tripathy SJ. (2023). Robust differences in cortical cell type proportions across healthy human aging inferred through cross-dataset transcriptome analyses. Neurobiol. Aging. DOI: 10.1016/j.neurobiolaging.2023.01.013.
- Guet-McCreight A, et al. (2022). Age-dependent increased sag amplitude in human pyramidal neurons dampens baseline cortical activity. Cereb. Cortex. DOI: 10.1093/cercor/bhac348.
- Yao HK*, Guet-McCreight A*, et al. (2022). Reduced inhibition in depression impairs stimulus processing in human cortical microcircuits. Cell Reports. 38(2). DOI: 10.1016/j.celrep.2021.110232. Asterisk denotes authors who contributed equally to this work.
- Howard D, Chameh HM, Guet-McCreight A, Hsiao HA, Vuong M, Seo YS, Shah P, Nigam A, Chen Y, Davie M, Hay E, Valiante TA, Tripathy S. (2022). An in vitro whole-cell electrophysiology dataset of human cortical neurons. GigaScience. DOI: 10.1093/gigascience/giac108.
- Guet-McCreight A, Skinner FK. (2021). Deciphering how interneuron specific 3 cells control oriens lacunosum-moleculare cells to contribute to circuit function. J. Neurophysiol. 126(4):997-1014. DOI: 10.1152/jn.00204.2021.
- Guet-McCreight A, Skinner FK. (2020). Computationally going where experiments cannot: a dynamical assessment of dendritic ion channel currents during in vivo-like states [version 2; peer review: 2 approved]. F1000Research. DOI: 10.12688/f1000research.22584.2.
- Guet-McCreight A, Skinner FK, Topolnik L. (2020). Common Principles in Functional Organization of VIP/Calretinin Cell-Driven Disinhibitory Circuits Across Cortical Areas. Front. Neural Circuits. DOI: 10.3389/fncir.2020.00032. This article was included as part of the Frontiers in Neural Circuits - Editors Pick 2021 collection (link).
- Luo X*, Guet-McCreight A*, et al. (2020). Synaptic Mechanisms Underlying the Network State-Dependent Recruitment of VIP-Expressing Interneurons in the CA1 Hippocampus. Cereb. Cortex. DOI: 10.1093/cercor/bhz334. Asterisk denotes authors who contributed equally to this work.
- Francavilla R, Guet-McCreight A, Amalyan S, Hui CH, Topolnik D, Michaud F, Marino B, Tremblay ME, Skinner FK, Topolnik L. (2020). Alterations in intrinsic and synaptic properties of hippocampal CA1 VIP interneurons during aging. Front. Cell. Neurosci. DOI: 10.3389/fncel.2020.554405.
- Sekulic V, Yi F, Garrett T, Guet-McCreight A, Lawrence JJ, Skinner FK. (2020). Integration of Within-Cell Experimental Data With Multi-Compartmental Modeling Predicts H-Channel Densities and Distributions in Hippocampal OLM Cells. Front. Cell. Neurosci. DOI: 10.3389/fncel.2020.00277.
- Guet-McCreight A, Skinner FK. (2019). Using computational models to predict in vivo synaptic inputs to interneuron specific 3 (IS3) cells of CA1 hippocampus that also allow their recruitment during rhythmic states. PLoS One. DOI: 10.1371/journal.pone.0209429.
- Guet-McCreight A, et al. (2016). Using a semi-automated strategy to develop multi-compartment models that predict biophysical properties of interneuron specific 3 (IS3) cells in hippocampus. eNeuro. DOI: 10.1523/ENEURO.0087-16.2016.
Prépublications
- Guet-McCreight A, Tripathy S, Sibille E, Hay E. Linking age changes in human cortical microcircuits to impaired brain function and EEG biomarkers. Biorxiv. DOI: 10.1101/2025.07.
- Moghbel F, Hassan MT, Guet-McCreight A, Hay E. Deriving connectivity from spiking activity in biophysical cortical microcircuits. Biorxiv. DOI: 10.1101/2024.06.13.598937.
Prix
- 2024-2027 CIHR Fellowship - Priority Announcement: Aging ($70,000/year)
- 2024-2026 Canadian Neuroanalytics Scholars Program ($70,000/year) - Declined
- 2023-2024 Labatt Family Research Fellowships in Depression Biology ($85,000)
- 2021-2022 Yuet Ngor Wong Award ($10,000)
- 2017-2019 NSERC CGS-D Scholarship ($35,000/year)
- 2016-2017 QEII-GSST Scholarship ($15,000)
- 2015-2016 QEII-GSST Scholarship ($15,000)
- 2015-2016 Unilever/Lipton OSOTF Graduate Fellowship ($2,000)
- 2013-2014 Mary H. Beatty Fellowship (Top-Up Award) ($5,000)
- 2013-2014 NSERC CGS-M Scholarship ($17,500)
- 2013 NSERC Undergraduate Student Research Award ($4,500)
- 2012-2013 Carleton Academic Scholarship ($2,500)
- 2011-2012 Carleton Academic Scholarship ($2,500)
- 2010-2011 Michael Oliver Scholarship ($2,500)
- 2010-2011 OUA Academic Achievement Award ($2,500)
- 2009-2010 Sprott Bursary ($4,500)
- 2009-2010 Doctor E. Bruce Tovee Award ($1,500)
- 2009-2013 Carleton University Dean’s Honor List
Code
- Human L2/3 Cortical Circuit Model for Therapeutic Dose Prediction of New Pharmacology in Depression (Développeur principal).
URL: GitHub Repo.
DOI de la publication associée: 10.1371/journal.pcbi.1012693.
- Human L2/3 Cortical Circuit Model for Testing New Pharmacology in Depression (Développeur principal).
URL: GitHub Repo.
DOI de la publication associée: 10.1038/s42003-024-05907-1.
- Human L5 Cortical Microcircuit models (Développeur principal).
URL: ModelDB.
DOI de la publication associée: 10.1093/cercor/bhac348.
- Human L2/3 Cortical Microcircuit models (Co-développeur).
URL: ModelDB.
DOI de la publication associée: 10.1016/j.celrep.2021.110232.
- CA1 Hippocampal Oriens Lacunosum Moleculare Interneuron rhythmic control simulations (Développeur principal).
URL: GitHub Repo.
DOI de la publication associée: 10.1152/jn.00204.2021.
- CA1 Hippocampal Oriens Lacunosum Moleculare Interneuron in vivo virtual neural network simulations (Développeur principal).
URL: ModelDB.
DOI de la publication associée: 10.12688/f1000research.22584.2.
- CA1 Hippocampal Oriens Lacunosum Moleculare Interneuron models (Co-développeur).
URL: GitHub Repo.
DOI de la publication associée: 10.3389/fncel.2020.00277.
- CA1 Hippocampal Interneuron Specific 3 Interneuron in vivo virtual neural network simulations (Développeur principal).
URL: ModelDB.
DOI de la publication associée: 10.1093/cercor/bhz334.
- CA1 Hippocampal Interneuron Specific 3 Interneuron models (Développeur principal).
URL: ModelDB.
DOI de la publication associée: 10.1523/ENEURO.0087-16.2016.

